|
Где можно посмотреть информацию о физических ограничениях на значения характеристик компьютеров |
Свойства молекул, лежащие в основе молекулярной элементной базы информатики
Введение
Молекулярная элементная база информатики – это элементы и устройства информатики, функционирование которых основано на свойствах отдельных молекул, атомов и супрамолекулярных структур.
Нижняя граница нанометрового диапазона размеров – от 1 до 10 нм – совпадает с размерами больших молекул. Поэтому молекулярная элементная база информатики является важной составной частью и одновременно естественным продолжением наноэлектронной элементной базы в субнанометровую, т.е. уже в "пикометровую" область размеров.
Рассмотренные в предыдущих разделах виды НЭБИ созданы людьми и начали применяться только в последние 100 лет. В отличие от этого, молекулярная элементная база информатики используется в природе уже миллиарды лет. Ведь именно она является основой информационных процессов, происходящих в живых клетках, в одноклеточных и в многоклеточных организмах. Когда Вас атакуют вирусы гриппа, властно изменяя на определенное время весь план Вашей жизни, они используют для "атаки" именно молекулярную элементную базу информатики. И когда Ваша иммунная система в ответ на эту "атаку" вырабатывает и мобилизует защитные антитела, то она тоже использует свою молекулярную элементную базу информатики.
Раздел науки, который изучает и разрабатывает молекулярную элементную базу информатики, называют "молекулярной электроникой" (англ. molecular electronics) или сокращенно "молетроникой" (англ. moletronics).
Квантово-механический взгляд на строение молекул
Атомы объединяются в молекулы с помощью "химических связей", возможность возникновения которых является результатом квантово-механического взаимодействия их электронных оболочек. Как правило, в образовании химических связей принимают участие лишь внешние электронные оболочки атомов – "валентные электроны". Природу химических связей объяснила квантовая механика. Ее относительно молодая "ветвь" – квантовая химия – позволяет сейчас рассчитать на современных компьютерах даже довольно сложные молекулы или их фрагменты, в частности, взаимное пространственное расположение атомов (с точностью порядка 1 пм), углы между химическими связями, энергию основных и возбужденных состояний и даже промоделировать и показать в виде видеороликов, как именно происходит химическая перестройка электронных оболочек при химических реакциях.
Можно смело утверждать, что молекулы – это уже целиком квантовые объекты, проектирование, количественное моделирование и поиск путей усовершенствования которых уже невозможны без квантово-механических расчетов и без "квантово-механического стиля мышления". Чтобы настроить вас на такое "квантово-механическое мышление", напомним кратко основные знания о молекулах, которые должны быть вам известны из курсов физики и химии, а также о некоторых менее известных, однако очень важных фактах.
Атомные орбитали
Наиболее приемлемой (в смысле доступности и вместе с тем соответствия реалиям) моделью только что упомянутого "квантово-механического мышления", которая позволяет понять физическую суть и особенности процессов, предопределяющих образование и долговременную стойкость молекул, является модель атомных и молекулярных орбиталей. Название и понятие "орбиталь" (в отличие от "орбита") указывают на то, что электроны в атомах и молекулах не движутся по фиксированным орбитам, как представляли себе раньше классическая физика и "планетарная" модель атома, а образуют вокруг ядра атома относительно стабильные стоячие волны определенной формы – атомные орбитали.
С точки зрения математического формализма квантовой механики каждой атомной орбитали (далее будем использовать сокращение "АО") соответствует определенное решение  стационарного уравнения Шредингера для атома при том или ином разрешенном наборе четырех квантовых чисел:
стационарного уравнения Шредингера для атома при том или ином разрешенном наборе четырех квантовых чисел: 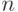 (главное квантовое число, которое может принимать лишь целые значения 1, 2, ...);
(главное квантовое число, которое может принимать лишь целые значения 1, 2, ...); 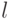 (орбитальное квантовое число, которое может принимать целые значения от 0 до
(орбитальное квантовое число, которое может принимать целые значения от 0 до  );
); 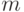 (магнитное квантовое число, которое может принимать целые значения от
(магнитное квантовое число, которое может принимать целые значения от  до
до 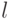 ) и
) и  (спиновое квантовое число, которое может принимать лишь два значения:
(спиновое квантовое число, которое может принимать лишь два значения:  .
.
Поскольку  - это плотность вероятности пребывания электрона, находящегося в состоянии
- это плотность вероятности пребывания электрона, находящегося в состоянии  , в точке атома со сферическими координатами
, в точке атома со сферическими координатами  , то волновая функция
, то волновая функция  описывает форму и плотность электронного "облака" или, другими словами, распределение плотности соответствующей стоячей электронной волны по объему атома.
описывает форму и плотность электронного "облака" или, другими словами, распределение плотности соответствующей стоячей электронной волны по объему атома.
Совокупность электронов на атомных орбиталях, соответствующих одному и тому же главному квантовому числу 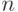 , называют электронной оболочкой. Совокупность электронов на АО, которые соответствуют двум одинаковым квантовым числам
, называют электронной оболочкой. Совокупность электронов на АО, которые соответствуют двум одинаковым квантовым числам 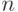 и
и 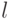 , называют электронной подоболочкой. Электроны с орбитальным квантовым числом
, называют электронной подоболочкой. Электроны с орбитальным квантовым числом  принято называть s-электронами, с орбитальным квантовым числом
принято называть s-электронами, с орбитальным квантовым числом  -
-  -электронами, с орбитальным квантовым числом
-электронами, с орбитальным квантовым числом  -
- 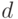 -электронами, с орбитальным квантовым числом
-электронами, с орбитальным квантовым числом  -
-  -электронами.
-электронами.
АО  -электронов имеют сферическую симметрию, т.е. их волновая функция не зависит от углов (
рис.
3.1).
-электронов имеют сферическую симметрию, т.е. их волновая функция не зависит от углов (
рис.
3.1).

Рис. 3.1. Изображение атомной s-орбитали: слева – в виде плотности вероятности, справа – в виде поверхности постоянной плотности вероятности
Слева показан  -электрон в виде электронного облака, т.е. распределение плотности вероятности пребывания электрона в соответствующем месте вокруг ядра (размещенного в центре системы координат). Электронное облако размыто и не имеет определенной точной границы. Чтобы легче было наглядно представить себе форму орбиталей, их принято изображать в виде поверхности постоянной плотности вероятности, такой чтобы вероятность пребывания электрона внутри объема, ограниченного этой поверхностью, равнялась 0,9 или 0,99. АО
-электрон в виде электронного облака, т.е. распределение плотности вероятности пребывания электрона в соответствующем месте вокруг ядра (размещенного в центре системы координат). Электронное облако размыто и не имеет определенной точной границы. Чтобы легче было наглядно представить себе форму орбиталей, их принято изображать в виде поверхности постоянной плотности вероятности, такой чтобы вероятность пребывания электрона внутри объема, ограниченного этой поверхностью, равнялась 0,9 или 0,99. АО  -электронов не имеют сферической симметрии, но имеют осевую симметрию относительно соответствующей оси (
рис.
3.2 вверху). АО
-электронов не имеют сферической симметрии, но имеют осевую симметрию относительно соответствующей оси (
рис.
3.2 вверху). АО 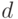 -электронов и
-электронов и  -электронов еще более сложны (
рис.
3.2 снизу).
-электронов еще более сложны (
рис.
3.2 снизу).

Рис. 3.2. Изображения атомных орбиталей: вверху – р-орбитали; внизу – d-орбитали и одна из f-орбиталей
Каждому набору квантовых чисел  соответствует свое значение энергии электрона на соответствующей АО. Электроны заполняют в атоме орбитали, которым соответствует наиболее низкая возможная энергия.
соответствует свое значение энергии электрона на соответствующей АО. Электроны заполняют в атоме орбитали, которым соответствует наиболее низкая возможная энергия.
По известному принципу Паули каждая АО может быть занята лишь одним электроном. Каждому набору трех квантовых чисел  соответствуют две очень похожие орбитали со спиновыми квантовыми числами
соответствуют две очень похожие орбитали со спиновыми квантовыми числами  . Поэтому на первой электронной оболочке с главным квантовым числом
. Поэтому на первой электронной оболочке с главным квантовым числом 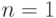 (
( ) имеются лишь две
) имеются лишь две  -орбитали, на которых могут находиться лишь 2 электрона с противоположными направлениями спинов.
-орбитали, на которых могут находиться лишь 2 электрона с противоположными направлениями спинов.
На второй электронной оболочке с главным квантовым числом 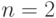 также имеются две
также имеются две  -орбитали, на которых могут находиться 2 электрона, и 6
-орбитали, на которых могут находиться 2 электрона, и 6  -орбиталей, соответствующих наборам квантовых чисел
-орбиталей, соответствующих наборам квантовых чисел  , на которых могут находиться 6 электронов.
, на которых могут находиться 6 электронов.
На третьей электронной оболочке с главным квантовым числом  , кроме описанных двух
, кроме описанных двух  -орбиталей и шести
-орбиталей и шести  -орбиталей, на которых могут находиться в сумме 8 электронов, появляются еще 10
-орбиталей, на которых могут находиться в сумме 8 электронов, появляются еще 10 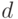 -орбиталей, на которых могут находиться еще 10 электронов.
-орбиталей, на которых могут находиться еще 10 электронов.
Размеры АО с увеличением атомного номера 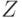 уменьшаются приблизительно в
уменьшаются приблизительно в 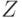 раз, а с увеличением главного квантового числа возрастают приблизительно как
раз, а с увеличением главного квантового числа возрастают приблизительно как 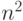 . Поэтому внутренние электронные оболочки атомов (с меньшими значениями квантового числа
. Поэтому внутренние электронные оболочки атомов (с меньшими значениями квантового числа 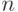 ) имеют значительно меньшие размеры и "скрыты" глубоко внутри внешних.
) имеют значительно меньшие размеры и "скрыты" глубоко внутри внешних.
Для внешних (валентных) электронов атома его ядро и внутренние атомные электронные оболочки образуют "квази-ядро", внутренний остов, суммарный положительный электрический заряд которого меньше, чем заряд ядра. Например, у атомов второго периода периодической системы элементов остовом атома является ядро, экранированное внутренней электронной оболочкой, т.е. катион с положительным электрическим зарядом ( ). У атомов третьего периода остовом атома является ядро, экранированное двумя внутренними электронными оболочками, т.е. катион с положительным электрическим зарядом (
). У атомов третьего периода остовом атома является ядро, экранированное двумя внутренними электронными оболочками, т.е. катион с положительным электрическим зарядом ( ).
).
В основном состоянии в атоме заполнены те АО, которым соответствуют наиболее низкие уровни энергии. Характер заполнения АО в основном состоянии атома задают записями типа:

Эта запись означает, что (в данном примере – в атоме фосфора) полностью заполнены первая и вторая внутренние электронные оболочки, а на третьей, внешней, электронной оболочке полностью занята  -подоболочка и на
-подоболочка и на  -,
-,  - и
- и  -орбиталях находятся по одному электрону.
-орбиталях находятся по одному электрону.
